НЕЙРООНКОЛОГИЯДАҒЫ БИОБАНК
Министерство здравоохранения Республики Казахстан
АО «Национальный центр нейрохирургии»
С.К. Акшулаков, Б.Б. Жетписбаев, А.Ж. Доскалиев,
К.Т. Сыдыкова, М.П. Солодовников
БИОБАНК В НЕЙРООНКОЛОГИИ
(Методические рекомендации)
Министерство здравоохранения Республики Казахстан
АО «Национальный центр нейрохирургии»
С.К. Акшулаков, Б.Б. Жетписбаев, А.Ж. Доскалиев,
К.Т. Сыдыкова, М.П. Солодовников
БИОБАНК В НЕЙРООНКОЛОГИИ
(Методические рекомендации)
Астана
2022
УДК: 616.8 – 006 : 616 -006.484 : 616-093
ББК: 56.1 : 55694.612
Рецензенты:
1. Абильдинова Гульшара Жусуповна - д.м.н. профессор, главный внештатный генетик Министерства здравоохранения Республики Казахстан;
2. Рыскельдиев Нуржан Амирбекович – к.м.н., ассоциированный профессор, врач-нейрохирург, заведующий отделением патологии центральной нервной системы АО «Национальный центр нейрохирургии» МЗ РК.
Авторы:
Акшулаков С.К. – д.м.н., профессор, академик НАН РК, Председатель правления АО «Национальный центр нейрохирургии».
Жетписбаев Б.Б. – заведующий патологоанатомическим отделением, профессор АО «Национальный центр нейрохирургии».
Доскалиев А.Ж. – PhD, Директор по стратегии и науке, врач-нейрохирург АО «Национальный центр нейрохирургии».
Сыдыкова К.Т. – ассистент лаборатории, Кафедра Биологии, Назарбаев Университет.
Солодовников М.П. – ученый секретарь, начальник отдела менеджмента научных исследований АО «Национальный центр нейрохирургии».
Биобанк в нейроонкологии: Методические рекомендации / Акшулаков С.К., Жетписбаев Б.Б., Доскалиев А.Ж., Сыдыкова К.Т., Солодовников М.П. // Астана: Национальный центр нейрохирургии, 2022. – 24 с.
ISBN
Данные методические рекомендации являются первым изданием такого рода для нейрохирургов, онкологов, врачей лаборантов и патологоанатомов Республики Казахстан, где описан профессиональный сбор биологических образцов у нейроонкологических пациентов (фрагменты опухолевой ткани и компоненты венозной крови). Представлена техника забора и методики обработки биоматериала, с последующей криогенной консервацией образцов.
Издание предназначено для нейрохирургов, онкологов и патологоанатомов.
УДК: 616.8 – 006 : 616 -006.484 : 616-093
ББК: 56.1 : 55694.612
Утверждено и разрешено к изданию типографским способом Республиканским центром развития здравоохранения Республики Казахстан (протокол заседания
Департамента развития медицинской науки и образования РГП РЦРЗ» № ___от «__» ______года)
© Акшулаков С.К., Жетписбаев Б.Б., Доскалиев А.Ж., Сыдыкова К.Т.,
Солодовников М.П., 2022
Перечень сокращений, условных обозначений, символов
|
BTRUS |
Central Brain Tumor Registry of the United States |
|
ESBB |
Ближневосточное и Африканское общество биоконсервации и биобанкинга |
|
ISBER |
Международное общество биологических и экологических хранилищ |
|
NOS |
Без дополнительного уточнения |
|
ВОЗ |
Всемирная Организация Здравоохранения |
|
ГБ |
Глиобластома |
|
ИГХ |
Иммуногистохимия / иммуногистохимическое исследование |
|
КТ |
Компьютерная томография |
|
МРТ |
Магнитно-резонансная томография |
|
ПА |
Пилоцитарная астроцитома |
|
ПО |
Первичные опухоли |
|
ЦНС |
Центральная нервная система |
СОДЕРЖАНИЕ
|
Перечень сокращений, условных обозначений, символов |
3 |
|
Введение |
5 |
|
1. Отечественный и международный опыт организации биобанкирования в развитых странах |
7 |
|
1.1. Перечень основных СОПов при биобанкировании |
11 |
|
2. Забор образцов опухолевой ткани |
11 |
|
3. Забор венозной крови и алликвотирование |
17 |
|
Заключени |
22 |
|
Список использованной литературы |
24 |
ВВЕДЕНИЕ
Сегодня весь мир живет в эпоху прогрессирования биомедицинских технологий: развивается персонализированная медицина, высокотехнологичные методы диагностики и лечения заболеваний, повсеместно ведутся глобальные эпидемиологические исследования. Большей своей частью все это стало возможным благодаря созданию и развитию биобанкирования. Сейчас биобанк – является одним из неотъемлемых компонентов современных масштабных исследовательских проектов в области медицины.
В большинстве стран мира биобанки являются частью финансируемых национальным правительством исследований, посвященных здоровью населения и биобезопастности страны. Основная задача данной инфраструктуры – это профессиональный сбор биологических образцов (фрагменты опухолевой ткани и компоненты венозной крови), которые могут быть изучены в отношении широкого спектра молекулярно-биологических параметров.
Биобанкирование биологических образцов хорошо развито в странах Европы. В Российской Федерации в настоящее время функционирует около 20 хранилищ биоматериала, это культуры первичных и метастатических опухолей.
В Республике Казахстан же данное направление только развивается. Известны такие отечественные биорепозитории как биобанки Назарбаев Университета, Национального центра биотехнологий, Научного центра акушерства, гинекологии и перинатологии, Казахского национального медицинского университета имени Асфендиярова, Национального научного медицинского центра. Здесь хранятся микроорганизмы, клеточные культуры, геномные и генно-инженерные биоматериалы для сохранения биоразнообразия и обеспечения ресурсной базы биотехнологий [1].
В настоящее время специализированных биобанков по хранению образцов опухолей центральной нервной системы (ЦНС) в Республике Казахстан не существует, что явилось поводом для создания биобанка в нейрохирургии на базе АО «Национальный центр нейрохирургии» (АО НЦН). В нашем биобанке хранятся опухоли глиального ряда, редко встречающиеся опухоли ЦНС и опухоли предоставляющие собой сложности в клинико-патоморфологической диагностике. У пациентов помимо образцов опухолевой ткани для криоконсеравации забиралась венозная кровь с последующим алликвотированием и получением ее компонентов (плазма, лейкоцитарный слой и сыворотка). В создании биобанка важную роль играют также правовые и этические вопросы, касающиеся информированного согласия, конфиденциальности и защиты данных пациента.
Согласно международным этическим нормам в области научных исследований, информированное согласие должно гарантировать добровольное участие, анонимность и абсолютную безопасность личных данных пациента [2].
Специализированный биобанк опухолей ЦНС на базе АО «НЦН» станет уникальным не только в Республике Казахстан, но и в странах дальнего и ближнего зарубежья. Биобанк позволит проводить как фундаментальные исследования молекулярной биологии и глиомогенеза, так и клинические исследования поиска и создания современных противоопухолевых лекарственных препаратов, методов детекции их эффективности, изучения возможных факторов риска развития опухолей и способов их эффективного мониторирования.
Актуальность методической рекомендации заключается в том, чтобы раскрыть, а также показать значимость и этапы создания биобанка опухолей ЦНС.
1. Отечественный и международный опыт организации
биобанкирования в развитых странах.
На сегодняшний день во многих развитых странах мира существуют биобанки. Разные по своей форме и наполнению, частные, при университетских клиниках и национальные.
В эпоху персонализированной медицины биобанки несут в себе основной целью развитие научно-исследовательского потенциала и биобезопастность страны, являясь уникальной платформой для привлечения инвестиций.
Состав и объем биобанков во всем мире остается различным, в зависимости от приоритета исследований, но общим практически во всех биобанках является:
1. наличие СОПов;
2. наличие информированных согласий;
3. работа по единым стандартам;
4. строгое соблюдение этических требований в отношении прав пациентов и доноров;
5. эффективно организованная логистика;
6. непрерывный мониторинг условий хранения;
7 выполнение всех процедур биобанкирования в соответствии с едиными международными стандартами
В большинстве развитых стран мира таких как Корея, Швеция, Австрия, сеть Евробиобанк (EuroBioBank) (Франция, Германия, Венгрия, Италия, Мальта, Словения, Испания, Великобритания и Турция, Ираиль, Канада), имеются крупные централизованные биобанки работающие по выше упомянутым требованиям.
Сеть Евробиобанк организация биобанков редких заболеваний созданная в 2017 году и состоящая из 25 членов государств, является первой действующей сетью биобанков в Европе, предоставляющей образцы человеческой ДНК, клеток и тканей в качестве услуги научному сообществу, проводящему исследования редких заболеваний. Это единственная сеть, посвященная исследованиям редких заболеваний в Европе. Ежегодно с помощью каталога образцов собирается примерно 13 000 новых образцов, а 7 000 образцов распространяются в Европе и за ее пределами. В настоящее время сеть содержит образцы для более чем 950 редких заболеваний [3].
Так, например Национальный биобанк Кореи (НБК) представлен как национальный центр управления сбора и использования человеческих биоресурсов. НБК интегрирован с 17 региональными биобанками и содержит в себе более 525 тысяч образцов по различным направлениям (сыворотка крови, плазма, ДНК и др.), насчитывает более 450 морозильных установок с жидким азотом, а также имеет автоматизированную систему управления биологическими образцами [1].
Биобанк Швеции также организован как Национальный комитет, в который входят представители всех регионов с имеющимися в них организациями здравоохранения, университетами в которых имеются развитые медицинские, биологические факультеты. Биобанк Швеции пользуется поддержкой ассоциаций и имеет тесное сотрудничество с рабочей группой Геномной медицины Швеции [4]. Финансирование биобанка Швеции осуществляется за счет Национального научно-исследовательского совета с четкой ориентацией на эффективность и устойчивость в исследованиях связанных с молекулярной и геномной медициной. Национальная программа биобанков Швеции обеспечивает сохранение трех-четырех миллионов биообразцов, получаемых ежегодно в ходе обычных медицинских обследований [5, 6, 7].
Биобанки Австрии представлены на национальном уровне центральной организацией BBMRI состоящей из австрийских университетов и биобанков связывающий их с целью создания национальной исследовательской инфраструктуры биобанков для ускорения биомедицинских исследований.
Одним из крупнейших и успешных биобанков Австрии является Университетский биобанк Граца (Грац), являющийся одним из крупнейших и наиболее известных клинических биобанков в мире, в нем хранится порядка 20 миллионов отдельных образцов биологических жидкостей и тканей человека.
Грац предоставляет доступ к этим образцам и связанным с ними данным в целях научно – исследовательских работ. Основная цель существования биобанка, это проведение биомедицинских исследований и связь между звеньями науки, медицины и бизнеса. Грац поддерживает академических и промышленных партнеров проводящих научно-исследовательские работы, разработки с поиском новых терапевтических подходов и диагностических процедур.
Субсидируется биобанк государством и был создан в 2007 году как некоммерческий центральный исследовательский центр Медицинского университета Граца.
Всего в биобанке насчитывается около 20 миллионов образцов.
Биобанк Грац сертифицирован Международной организацией по стандартизации (ISO), системы управления качеством (9001: 2008). Хранение проб частично или полностью автоматизировано для поддержания оптимального качества проб с высокой скоростью извлечения. Получив общее расширенное информированное согласие, Biobank Graz распространяет образцы по всему миру для этически одобренных научно - исследовательских проектов [8,9,10].
Процесс формирования биобанка начинается с определения целей, которые не должны быть узконаправленными. Поставленная и четко сформированная цель определяет тип образцов. Процесс сбора образцов начинается с подписания информированного согласия пациента, которое должно быть одобрено местным этическим комитетом организации.
Функции органа, регулирующего работу биобанков, выполняет международная организация Международное общество биологических и экологических хранилищ (ISBER) и его филиал Европейское, Ближневосточное и Африканское общество биоконсервации и биобанкинга (ESBB).
Функции ISBER довольно широки - развитие биобанка и международной сети биобанков, накопление международного опыта, касающегося всех аспектов биобанка и его этапов, а также разработка рекомендаций.
В дополнение к ISBER, которая разрабатывает международные рекомендации по организации биобанков, существуют международные и европейские организации по стандартизации, которые разрабатывают стандарты для организации биобанков, а также процедуры предварительного анализа. В августе 2018 года Международная организация по стандартизации ISO опубликовала стандарт биобанкинга ISO 20387:2018 [11].
Строгое соблюдение всех необходимых этических норм и требований имеет огромное значение в области биобанкинга. Вопросы, связанные с созданием Биобанка, а также утверждением и введением в оборот различных документов, регулирующих его деятельность, должны быть рассмотрены на заседании Комитетом по биоэтике.
Вопросы предоставляемые на рассмотрение Комитету по биоэтике, включают:
соблюдение этических обязательств;
добровольное предоставление биологических образцов пациентами и донорами;
безопасность процедур, используемых для получения биологического материала;
безопасность персональных данных пациентов и доноров, за счет реализации алгоритмов обезличивания данных;
полнота информации, предоставляемой донорам биологических образцов о научных целях биобанкинга.
Наиболее важным вопросом, решаемым Комитетом по биоэтике, является рассмотрение и утверждение форм «Информированное согласие пациента на биобанкинга» и «Информация для пациентов», которые должны быть разработаны на основе рекомендаций ISBER [12,13].
Забор образцов крови и других жидкостей для биобанка обычно проводится на начальной стадии диагностики заболевания в амбулаторных условиях, либо в условиях круглосуточного стационара.
В случае взятия образцов тканей в исследовательских целях первостепенное внимание должно уделяться необходимости и важности полного диагноза. Образцы тканей будут помещены в биобанк только в том случае, если было получено необходимое количество материала для всех этапов диагностики заболевания. Привлечение патоморфолога, который должен подтвердить качество образца, крайне необходимо. При транспортировке образца должны соблюдаться все необходимые условия (время, температура и т.д.). Как только образец поступает в биобанк, он обезличивается, маркируется и обрабатывается.
На этом этапе решающим шагом является аликвотирование образцов. Аликвотирование - это процесс разделения нативного образца, либо выделенной фракции (плазмы, сыворотки) на образцы для улучшения условий замораживания и хранения, а также для создания копий образца, что позволяет тестировать его несколько раз у одного и того же пациента без ущерба для его качества.
Биобанки в настоящее время представляют собой уникальную исследовательскую инфраструктуру, нуждающуюся в адекватных гибких механизмах управления, которая не препятствует научному прогрессу.
Инструменты управления для индустрии биобанков предназначены для поддержания баланса между потребностями научного сообщества и донорами биологического материала, с акцентом на прозрачность и доверие на всех этапах работы.
В Республике Казахстан активно стали задумываться о создании биобанков не так давно, потому данный вопрос остается актуальным и свежим в нашей стране. В основном отправными точками для подобных решений становились послания Президента Республики Казахстан, обсуждения депутатов Мажилис Парламента, правки вносимые в Кодекс «О здоровье народа и системе здравоохранения» [14,15,16].
В Республике Казахстан биобанкирование только развивается, однако, уже сегодня есть множество образцов биоматериалов, которые хранятся в отечественных биорепозиториях, таких как: Казахский национальный медицинский университет имени Асфендиярова, Назарбаев Университет, Национальный научный медицинский центр, также Национальный центр биотехнологий. Здесь хранятся микроорганизмы, клеточные культуры, геномные и генно-инженерные материалы для сохранения биоразнообразия и обеспечения ресурсной базы биотехнологий [17]. Биобанк «Мирас» в АО «Научный центр акушерства, гинекологии и перинатологии» в городе Алматы был создан в рамках проекта 7 рамочной программы Еврокомиссии «Генетические исследования преэклампсии в центрально-азиатских и европейских популяциях», с целью идентификации и валидизации новых биологических маркеров, установление их связей с заболеваниями и идентификации новых терапевтических мишеней. На данный момент в биобанке «Мирас» хранятся 13950 образцов ДНК [18].
1.1. Перечень основных СОПов при биобанкировании:
Должностные инструкции, роли и обязанности персонала биобанка;
Образование и обучение биобанка;
Разработка и пересмотр информированных соглашений;
Получение информированных соглашений;
Отзыв информированных соглашений;
Набор участников в программу банка опухолей;
Контроль доступа к информации;
Системы резервного копирования баз данных;
Ведение документов;
Аварийная процедура при неисправности морозильной и холодильной камер;
Маркировка материалов биобанка;
Оценка качества образцов тканей;
Сбор и транспортировка крови;
Получение образцов;
Сбор и транспортировка тканей;
Хранение тканей;
Завершение работы биобанка.
2. Забор образцов опухолевой ткани
В настоящее время во всем мире отмечается рост частоты опухолей головного мозга, в том числе и глиом. Первичные опухоли ЦНС составляют около 2% от всех опухолей человека, или, по данным CBTRUS, – 21,4 случаев на 100 тыс. населения [19-22]. Среди ПО ЦНС преобладают менингиомы (36%, причем только 1% составляют злокачественные менингиомы) и глиомы (35,5%, причем 15.6% от общего числа первичных опухолей мозга составляет глиобластома). Заболеваемость опухолями головного мозга в 7-8 раз выше, нежели заболеваемость спинного мозга [19, 20]. Несмотря на свою относительную редкость (орфанность), опухоли ЦНС среди новообразований других локализаций занимают 2-е место у детей и 12-е место у взрослых. По данным Казахского канцеррегистра (показатели онкологической службы Республики Казахстан, Алматы за 2009), заболеваемость опухолями ЦНС в 2009 г. составила 600 наблюдений или 3,8 %. [23].
Диагностика глиом крайне сложна и требует определенных навыков и знаний у патологоанатома при макро-, микроскопическом изучении биоптата, оценки данных иммуногистохимического исследования, мутационного статуса и копийности генов-кандидатов, а также эпигенетических событий. С целью дальнейшего развития современных технологий, молекулярно-биологических методов, секвенирования, необходима концентрация и аккумуляция тканевого материала для достижения достаточных выборок, с формированием специализированных биобанков в нейроонкологии. Цель подобных биобанков - сделать опухолевую ткань доступной для большого числа исследований глиомогенеза.
Процедура забора опухолевой ткани и крови для криоконсервации начинается со сбора личных данных, в соответствии с законодательством Республики Казахстан и происходит после подписания пациентами информированного (добровольного) согласия. Пациент подходящий для исследования, дает письменное согласие на предоставление фрагментов опухолевой ткани, образцов венозной крови, данных клинических и диагностических исследований. Вся соответствующая информация хранится в единой электронной базе данных, которая доступна исключительно сотрудникам, участвующим в исследовании.
Информированное согласие хранится также в письменной форме в документах Биобанка.
В информированном согласии указываются идентификационные данные пациента, разъяснительная информация с какой целью проводится забор образцов опухолевой ткани и венозной крови. В обязательном порядке информированное согласие подписывается пациентом. Для сохранения конфиденциальности и анонимности данных пациента присваивается индивидуальный порядковый идентификатор.
В исследования включены пациенты с подозрением на опухолевое образование головного или спинного мозга глиального происхождения. Формирование коллекции образцов опухолевой ткани, полученных от пациентов с глиомами связано с использованием двух видов консервации биологического материала быстрого замораживания в жидком азоте и изготовления парафиновых блоков.
Во время операции забор образцов опухолевой ткани производится врачом нейрохирургом, вне зон некроза, кровоизлияний и аутолиза (см. рисунок 1). Образцы опухолевой ткани передаются в лабораторию в жидком азоте вместе с подписанным информированным согласием и направлением на патогистологическое исследование, которое находится на одной территории с операционным блоком. Врач патологоанатом проводит вырезку фрагментов ткани. Одну часть ткани размерами примерно 0,5х0,5х0,3см помещают в криопробирку объемом 2 мл, после чего материал переносят в низкотемпературный морозильник с температурой -80ºС (криохранилище). Вторая часть материала используется для изготовления парафинового блока, с последующим патоморфологическим, иммуногистохимическим и молекулярно-генетическим исследованиями. Время с момента транспортировки биоматериала с операционного блока до момента заморозки препарата в лабораторию занимает не более 20 мин (см. рисунок 2).

Рисунок 1 – Зоны интраоперационного забора образцов опухолевой ткани
(Художник А. Алиева).
В электронной базе биобанка содержится вся информация о пациенте: данные МРТ и КТ исследований, патогистологическое заключение с данными иммуногистохимического и молекулярно-генетического исследований. В процессе патоморфологической диагностики глиом используется широкая панель иммуногистохимических антител и молекулярно-генетических маркеров. Молекулярно-генетические исследования проводятся на генетическом анализаторе «Applied Biosystems 3500xL», методом секвенирования по Сэнгеру и фрагментным анализом (MLPA) с определением многочисленных мутаций имеющих как диагностическое так и прогностическое значение: (см. таблицу № 1 и 2).
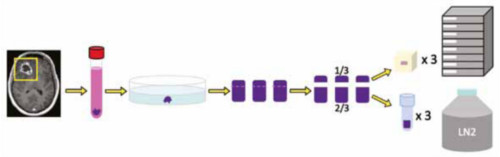
Рисунок 2 – Схема пути образца опухоли [2].
Таблица 1 – Молекулярно-генетические исследования.
|
№ |
Наименование исследования |
Клиническое значение |
|
1 |
IDH1-IDH2 |
Прогностическое значение – IDH1 и IDH2 – взаимоисключающие: IDH mut - положительный прогностический маркер, демонстрирует более высокие показатели общей выживаемости, IDH wt - более агрессивное течение. |
|
2 |
MGMT |
Прогностическое значение. При наличии метилированного MGMT в опухоли, показана более высокая чувствительность к химиотерапии алкилирующими препаратами (темозоломид, производные нитрозомочевины). |
|
3 |
H3 K27M |
Диагностика диффузной глиомы средней линии. |
|
4 |
BRAF V600E |
Дифференциальная диагностика глиом. Возможно применение для дифференциации ПА. Чаще встречается в супратенториальных ПА. Положительный прогностический маркер у детей и молодых пациентов |
|
5 |
Ко-делеция 1p/19q |
Выявление коделеции 1p/19q позволяет проводить дифференциальную диагностику анапластической олигодендроглиомы от глиобластомы с олигодендроглиальным компонентом. Дифференциальная диагностика без FISH-анализа является невозможной, а правильная диагностика влияет на дальнейшую тактику лечения. Проспективные рандомизированные клинические исследования (фаза 3) подтвердили прогностическую и предиктивную значимость использования 1p/19q коделеции. Пациенты, у которых была обнаружена данная мутация показывают более хорошую ответную реакцию. |
|
Продолжение таблицы 1 |
||
|
6 |
CDKN2A/B |
Прогностический маркер, свидетельствующий о худшем прогнозе и выживаемости. |
|
7 |
ATRX |
Редко встречается без мутации IDH и ТР53, взаимоисключающая с коделецией 1p/19q. Возможно применение для дифференциации астроцитом и коделеции 1p/19q. При потере активности ATRX – прогноз более благоприятный. |
|
8 |
KIAA1549-BRAF |
Применяется в диагностике ПА, локализованных в спинном мозге и у основания черепа. |
|
9 |
ТР53 |
Онкоген, неблагоприятный прогностический фактор, обуславливает более агрессивное течение опухолевого роста. |
|
10 |
C-MYC и N-MYC амплификации |
Диагностика медуллобластом. |
|
11 |
MYC амплификация |
Диагностика MYC - амплифицированной медуллобластомы, свидетельствует о неблагоприятном исходе, с неконтролируемой прогрессией опухолевого роста и последующим быстрым летальным исходом. |
|
12 |
WNT-активация |
Выявляется в медуллобластомах и свидетельствует о более благоприятном исходе. |
|
13 |
SHH-активация |
Выявляется в медуллобластомах и свидетельствует о неблагоприятном исходе. |
|
14 |
C19MC альтерация |
Диагностика эмбриональной опухоли с многослойными розетками. Данная опухоль выявляется только на основании выявления данной альтерации. |
|
15 |
EGFR амплификация |
Типична для первичных ГБ. Редко встречается с мутацией IDH, взаимоисключающая с ТР53. Ассоциирована с высокой злокачественностью и ухудшенным прогнозом. Определяется при проведении таргетной терапии EGFR – ассоциированных глиобластом, препаратами иресса и тарцева. |
|
16 |
VEGF |
VEGF выявляют при проведении таргетной терапии, как ингибитор неоангиогенеза в опухолевых тканях. Определяется при назначении препарата авастин (бевацизумаб). |
|
17 |
RELA-fusion |
Выявляется при эпендимомах и свидетельствует о неблагоприятном прогнозе. |
Таблица 2 – Иммуногистохимическая дифференциально-диагностическая
панель глиом.
|
№ |
Название антитела |
Клиническое значение |
|
1 |
GFAP (глиальный фибриллярный кислый белок) |
Диагностика глиальных опухолей |
|
2 |
NSE (нейрон-специфическая энолаза) |
Диагностика нейрональных опухолей |
|
3 |
Synaptophysin |
Диагностика нейроглиальных и нейроэндокринных опухолей |
|
4 |
Cromogranin A |
Диагностика нейроглиальных и нейроэндокринных опухолей |
|
5 |
S100 |
Диагностика глиальных и шванновских клеток |
|
6 |
Ki67 |
Индекс пролиферативной активности |
|
7 |
Olig2 |
Диагностика олигодендроглиомы (вспомогательный маркер) |
|
8 |
ATRX |
Дифференциальная диагностика астроцитом с другими глиомами. Позитивная экспрессия ATRX свидетельствует об отсутствии мутации гена |
|
9 |
EMA (эпителиальный мембранный антиген) |
Диагностика эпендимом |
|
10 |
Panceratin (AE1/AE3) |
Дифференциальная диагностика с метастатическими опухолями |
|
11 |
H3 K27M |
Диагностика диффузной глиомы средней линии |
|
12 |
NeuN |
Диагностика нейрональных опухолей |
|
13 |
NB84 |
Диагностика нейробластомы |
|
14 |
Р53 |
Прогностическое |
|
15 |
B-катенин |
Диагностика медуллобластом |
|
16 |
LIN28a |
Диагностика эмбриональной опухоли с многослойными розетками |
|
17 |
STAT6 |
Диагностика солитарной фиброзной опухоли/гемангиоперицитомы |
|
18 |
SMARCB1 (INI1) |
Диагностика атипической тератоидно / рабдоидной опухоли: потеря экспрессии INI I, при сохранной экспрессии антитела в эндотелии сосудов |
|
Продолжение таблицы 2 |
||
|
19 |
Rhodopsin |
Диагностика пинеобластомы |
|
20 |
Retinal S-antigen |
Диагностика пинеобластомы |
|
21 |
Brachyury |
Диагностика хордомы |
|
22 |
SATB2 |
Диагностика остеосаркомы |
|
23 |
SOX10 |
Диагностика злокачественной опухоли оболочек периферического нерва |
|
24 |
CD163 |
Диагностика гистиоцитарной саркомы |
|
25 |
Anti MBT |
Диагностика туберкулеза |
|
26 |
Anti CMV |
Диагностика ЦМВ |
|
27 |
HSV 1, 2 |
Диагностика герпес вируса 1 и 2 типов |
|
28 |
Anti EBV |
Диагностика вируса Эпштейн-Барр |
|
29 |
OCT4 |
Диагностика герминомы |
|
30 |
PLAP |
Диагностика герминомы |
|
31 |
CD117/c-kit |
Диагностика герминогенных опухолей |
|
32 |
MAP2 |
Маркер нейрональных опухолей |
|
33 |
CD1a |
Диагностика гистиоцитоза из клеток Лангерганса |
|
34 |
Альфа-фетопротеин |
Для ИГХ диагностики эмбриональных опухолей. |
|
35 |
СD45, CD20, CD79a, CD3, TdT |
Дифференциальная диагностика с лимфомами. |
3. Забор крови и алликвотирование
Кровь является одним из наиболее часто используемых биообразцов и играет большую роль в поиске новых биомаркеров, а также в раннем выявлении и лечении сложных заболеваний [24]. По сравнению с другими биообразцами (например, опухолевая ткань), осуществить забор и обработку крови намного проще. Компонентами, наиболее часто используемых для хранения в биобанках являются:
Плазма - жидкая часть крови, которая остается после центрифугирования взвешенных клеток. Содержит факторы свертывания крови и растворенные электролиты;
Сыворотка - аналогична плазме, но не содержит факторов свертывания крови;
Лейкоцитарный слой - фракция крови, которая в основном содержит лейкоциты и тромбоциты;
Красные кровяные клетки [24].
Различные компоненты крови обеспечивают множество возможных применений. Например для клинического биохимического анализа используется сыворотка, а для анализов на основе ДНК или РНК анти-коагулированная (состоящая из плазмы, лейкоцитарного слоя и эритроцитов) [25]. Таким образом в зависимости от цели исследования кровь забирается в различные вакуумные пробирки и обрабатывается в зависимости химического состава пробирки. В таблице №3 указаны различные условия и характаристики для различных компонентов крови. Для взятия венозной крови используется вакуумная система, имеющая разную цветовую окраску крышечки: сиреневая (с ЭДТА) в объеме 10 мл и желтая (с активатором свертываемости) в объеме 5 мл.
Таблица 3 – Характеристики и условия хранения различных
компонентов крови [24].
|
Биообразец |
Характеристики сбора |
Использование |
Рекомендации по хранению |
|
Цельная кровь |
Антикоагулянты (КЦД, гепарин, ЭДТА); ингибитор протеазы для протеомики |
Геномные исследования, источник ДНК и РНК |
Хранить при температуре -80 °C, если выделение ДНК невозможно провести немедленно. |
|
Лейкоцитарный слой |
ЭДТА |
Источник ДНК и РНК |
Хранить при температуре -80°C для стабильности РНК |
|
Эритроциты |
ЭДТА |
Исследования гемоглобина, исследование мембранной протеомы. |
Следует разделить на аликвоты и хранить при температуре −80°C |
|
Плазма |
Гепарин лития/ЭДТА |
Протеомика; Источник ДНК; множественные исследования аналитов. |
Хранится при −80°C |
|
Сыворотка |
Без антикоагулянта |
Улучшенный анализ антител, питательные вещества, липиды и липопротеины. |
Хранится при −80°C |
Как видно из Таблицы 3, еще одним немаловажным фактором является температура хранения образцов. Напимер, ДНК в достаточном колличестве можно извлечь из образцов крови хранимых при комнатной температуре, +4оС или при - 20оС только в течение 1 месяца [26]. Длительное хранение вызывает лизис эритроцитов и, при тяжелом гемолизе, можно будет ожидать, лизиса лейкоцитов, что приведет к потере ДНК на этапе сбора лейкоцитов при экстракции ДНК [26]. Тогда как образцы, хранимые при температуре -80оС могут храниться в течении многих лет [25, 27, 28]. РНК более подвержена и быстро деградирует при температурах выше -80°С. Также было показано, что целостность микроРНК (миРНК) сохраняется в течение многих лет в образцах плазмы, хранящихся при температуре -80°C, что подчеркивает тот факт, что не все виды РНК в равной степени подвержены деградации [21]. Именно поэтому для длительного хранения образцы должны храниться при температуре не ниже −80°C [26].
В биобанке на базе нашего центра производится сбор и хранение сыворотки, плазмы и лейкоцитарного слоя (при возможности). Для забора крови и последующего получения сыворотки используется одна желтая вакуумная пробирка с активатором свертываемости объемом 5 мл. Для получения плазмы и лейкоцитарного слоя используется одна вакуумная пробирка с сиреневой крышкой содержащей ЭДТА объемом 10 мл или две объемом по 6 мл.
Забор венозной крови у пациента проводится только после получения информированного согласия. Процесс получения информированного согласия указан в Главе 1.
Врач, получавший информированное согласие у пациента, сообщает данные пациента, участвующего в исследовании ответственной медсестре. Медсестра в зависимости от времени полученной информации производит забор крови одновременно с забором крови, делаемой у пациента перед операцией, или приглашает пациента для процедуры в процедурный кабинет. В первую очередь заполняется кровью пробирка с ЭДТА, затем пробирка с активатором свертываемости. После забора крови пробирка с ЭДТА аккуратно переворачивается 8–10 раз, пробирка с активатором свертываемости 5 раз. Переворачивание необходимо делать аккуратно, избегая активного встряхивания. На пробирки клеится стандартная этикетка содержащая ФИО пациента, дату рождения, код пациента и название отделения. Ответственной медсестрой вручную указывается время произведения забора крови.
После забора крови медсестра уведомляет ответственного работника биобанка об осуществленном заборе крови и хранит пробирки при температуре +4оС (не более 4-х часов) [29, 30, 31]. Транспортировка крови из отделения в лабораторию осуществляется работником биобанка с помощью специального бокса для транспортировки.
После доставления крови в лабораторию, пробирку с активатором свёртываемости необходимо подержать при комнатной температуре 30 минут [32]. Далее, процентрифугировать не менее 10 минут с ускорением 1500G (примерно 3000 об/мин). Полученная сыворотка отбирается в заранее промаркированную криопробирку. Маркировка должна содержать следующую информацию: С (сыворотка), номер отделения и код субъекта, и адрес расположения криопробирки в морозильнике. Криопробирка хранится при температуре -80оС.
Пробирка(и) с ЭДТА центрифугируется при 1000-1500G (2000–3000об/мин), 10–30 минут. После, верхний слой (плазма) отбирается в две заранее промаркированные крипоробирки. Маркировка должна содержать следующую информацию: П1 и П2 (плазма), номер отделения и код субъекта, и адрес расположения криопробирки в морозильнике. Криопробирки хранятся при температуре -80оС. Следующий слой из пробирки с ЭДТА - лейкоцитарный слой, отделяется в объеме 750 мкл и перемещается в заранее промаркированную криопробирку. Затем в криопробирку добавляется 150 мкл охлажденного глицерола и содержимое криопробирки аккуратно перемешивается пипетированием. Маркировка должна содержать следующую информацию: ЛС (лейкоцитарный слой), номер отделения и код субъекта, и адрес расположения криопробирки в морозильнике. Криопробирки хранятся при температуре - 80оС.
Основной проблемой при отборе лейкоцитарного слоя является его объем (см. рисунок 3). При использовании вакуумной пробирки с большим объемом имеется возможность получить лейкоцитарный слой в достаточном объеме, однако при использовании нескольких пробирок с меньшим объемом создает трудность для забора в связи с очень тонким лейкоцитарным слоем.
Также, важно отметить что гемолизированная кровь не подходит для хранения в биобанке [27,29,34].
Во время центрифугирования пробирок необходимо заполнить электронную базу данных содержащую информацию о субъекте исследования (ФИО, номер истории болезни, даты рождения), о коде, присвоенном ему, а также о дате забора и обработки крови. В целях безопасности база данных и ноутбук с доступом к базе данных защищены паролем.
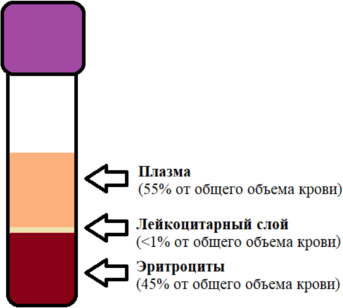
Рисунок 3 – Лейкоцитарный слой в пробирке с ЭДТА.
ЗАКЛЮЧЕНИЕ
За исследованный период (с 2018 по 2021 гг) в биобанке АО «НЦН» собраны 239 образцов опухолевой ткани от 239 пациентов. Число рекрутированных пациентов точно соответствует количеству собранных образцов опухолевой ткани в биобанке, с парафиновыми блоками в комплексе с клиническими и патогистологическими данными. Наряду с опухолевым материалом в коллекции собрано 956 аликвот образцов венозной крови пациентов. Средний возраст этих пациентов составил 62 года (диапазон 20 – 75 лет), показатели частоты заболеваемости у мужчин были выше, чем у женщин (см. таблицу 4).
Установление диагноза опухолей проводилось согласно ВОЗ классификации опухолей ЦНС (2016г и 2021г) на основании патогистологического, иммуногистохимического и молекулярно-генетического исследований. Во время иммуногистохимического исследования применялась широкая панель антител для диагностики и дифференциальной диагностики глиом. Согласно международным стандартам JCI в процессе диагностики постоянно проводился как внутренний, так и внешний контроль качества патоморфологических исследований. Внешний контроль качества осуществляли патологи Национального медицинского исследовательского центра нейрохирургии имени академика Н.Н. Бурденко г. Москва (Россия), Университетского медицинского центра г. Киль (Германия).
В биобанке имеются данные пациентов в основном с глиомами 3-4 степени злокачественности.
Таблица 4 – Количество образцов в биобанке.
|
Название диагноза, Grade |
Количество случаев |
|||
|
2018г |
2019г |
2020г |
2021г |
|
|
Глиобластома, G=IV |
31 |
16 |
14 |
18 |
|
Анапластическая олигоастроцитома, G=III |
8 |
5 |
10 |
5 |
|
Анапластическая эпендимома, G=III |
7 |
3 |
7 |
5 |
|
Анапластическая олигодендроглиома, G=III |
5 |
3 |
3 |
4 |
|
Анапластическая астроцитома, G=III |
4 |
4 |
4 |
7 |
|
Анапластическая плеоморфная ксантоастроцитома, G=III |
5 |
3 |
4 |
3 |
|
Глиосаркома, G=IV |
1 |
0 |
0 |
0 |
|
Глиальные опухоли GI-II, другие опухоли ЦНС |
71 |
9 |
3 |
7 |
|
Итого |
132 |
43 |
45 |
49 |
Таким образом, специализированный биобанк опухолей ЦНС на базе нашего Центра станет уникальным не только в Казахстане, но и в странах ближнего зарубежья. Биобанк позволит проводить как фундаментальные исследования молекулярной биологии и глиомогенеза, так и клинические исследования поиска и создания современных противоопухолевых лекарственных препаратов, методов детекции их эффективности, изучения возможных факторов риска развития опухоли и способов их эффективного мониторирования.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
А.Б. Касымова, Б.Б. Жетписбаев, А.Ж. Доскалиев, М.П. Солодовников, Н.А. Рыскельдиев. Организация биобанка в нейрохирургии. // Журнал и нейрохирургия и неврология Казахстана № № 3 (64) 2021 г.
Д.А. Гольбин, А.Л. Корочкина, С.В. Шугай, Т.В. Цуканова, М.А. Шифрин, А.В. Ревищин, А.В. Косырькова, Г.В. Данилов, Е.Ю. Рыбалкина, Г.В. Павлова, Г.Л. Кобяков и А.А. Потапов 2020. Опыт создания специализи-рованного биобанка глиом головного мозга человека. Клиническая и экспериментальная морфология. 9, 4 (дек. 2020), 39-49.
Электронный ресурс: http://www.eurobiobank.org/;
Электронный ресурс: http://www.kdca.go.kr/contents.es?mid=a50402010000 Wengenroth, M., Blatow, M., Guenther, J., Akbar, M., Tronnier, V. M., Stippich, C. (2011);
Электронный ресурс: https://genomicmedicine.se/en/;
Еропкин М.Ю. Биобанки и их роль в системах биобезопасности, здравоохранения,биотехнологии, экологии и «экономике знаний» DOI: 10.13140/RG.2.1.3229.7040 Research Gate
Электронный ресурс: https://biobanksverige.se/english/research/getting-started/about-biobank-sweden/;
Электронный ресурс: https://biobanksverige.se/en/about-biobank-sweden/ ;
Интернет ресурс: https://www.medunigraz.at/;
Lee YM, Grauffel C, Chen T et al. Factors Governing the Different Functions of Zn2+-Sites with Identical Ligands in Proteins. J Chem Inf Model 2019; 59 (9): 3946–54. DOI: 10.1021/acs.jcim.9b00617;
Haslacher H, Bayer M, Fiegl H et al. Quality management at the national biobanking level – establishing a culture of mutual trust and support: the BBMRI. at example. Clin Chem Lab Med 2019; 57 (12): 301–5. DOI: 10.1515/cclm-2019-0491;
Kaprin A., Ivanov S., Petrov V., Dukhova N, Dvinskikh N., Falaleeva N, et.al. Biobanki v onkologii: mirovoi opyt i rossiiskaya deistvitel’nost’. Sovremennaya onkologiya. 2020; 22(2). (in Russian);
Bledsoe M.J. Ethical Legal and Social Issues of Biobanking: Past, Present, and Future Biopreservation and Biobanking 2017; 15(2): 142-7;
Кодекс «О здоровье народа и системе здравоохранения» Статья 229 https://online.zakon.kz/Document/?doc_id=34464437&doc_id2=34464437#activate_doc=2&pos=287;-170&pos2=3718;-64 ;
https://www.inform.kz/ru/razvivat-biobanki-dlya-hraneniya-geneticheskogo-materiala-planiruyut-v-kazahstane_a3449437 ;
Постановление Правительства Республики Казахстан от 26 декабря 2019 года № 982 «Об утверждении Государственной программы развития здравоохранения Республики Казахстан на 2020 – 2025 годы» интернет ресурс: https://adilet.zan.kz/rus/docs/P1900000982;
https://tengrinews.kz/kazakhstan_news/biobanki-planiruyut-sozdat-v-kazahstane -357201/
http://www.nca.kz/info/articles/media/pervyy-mezhdunarodnyy-biobank-miras-v-rk/
David N. Louis et al. WHO Classification of tumours of the Central Nervous System. Lyon. 2016.
Peter C. Burger, MD et al. Diagnostic pathology, Neuropathology. 2012.
David J. Dabbs. Diagnostic immunohistochemistry, 4 edition, 2014.
Мацко Д.Е. Нейрохирургическая патология. СПб, 2015.
Б.Б. Жетписбаев, А.О. Кожахметова. Патоморфологическая диагностика опухолей центральной нервной системы. // Методические рекомендации, Нур-Султан, 2020;
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6777725/pdf/nihms-1051995.pdf;
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3982909/pdf/nihms562521.pdf;
https://onlinelibrary.wiley.com/doi/full/10.1046/j.15387836.2003.00216.x?sid=nlm%3Apubmed;
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2655764/pdf/nihms94453.pdf
https://pubmed.ncbi.nlm.nih.gov/22504138/
https://edrn.nci.nih.gov/archive/standard-operating-procedures/standard-operating-procedures/serum-sop.pdf;
Д.М. Байсханова, М.П. Солодовников, Б.Б. Жетписбаев. Биобанк образцов глиальных опухолей. Международная научно-практическая конференция молодых ученных и студентов, приуроченная к 30-летию Независимости Республики Казахстан. 09-10 декабря 2021г.;
Б.Б. Жетписбаев, А.Ж. Доскалиев, А.Б. Касымова, Рыскельдиев, Г.И. Оленбай, К.Т. Сыдыкова. Опыт создания биобанка в нейроонкологии. // Евразийский онкологический журнал № 2, том 10, 2022г. Тезисы к XIII Съезду онкологов и радиологов стран СНГ и Евразии, 27-29 апреля 2022г.
https://edrn.nci.nih.gov/archive/standard-operating-procedures/standard-operating-procedures/plasma-sop.pdf
https://edrn.nci.nih.gov/archive/standard-operating-procedures/standard-operating-procedures/plasma-sop.pdf
Н.А. Коновалов, Д.С. Асютин, Е.Г. Шайхаев, С.В. Капровой, С. Ю. Тимонин. Молекулярные биомаркеры астроцитом головного и спинного мозга. // ACTA NATURAE, том 11, № 2 (41), 2019.